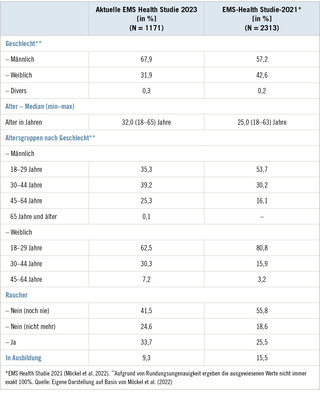
Künstliche UV-Strahlung durch Schweißen und Aderhaut-Melanome
Hintergrund: Die „International Agency for Research on Cancer“ (IARC) stellte einen Kausalzusammenhang zwischen Schweißen und dem Auftreten von Aderhautmelanomen her und stufte Schweißen in ihrer Monographie 100D (2012) als Humankanzerogen ein. Es wurde nun geprüft, ob nach dem deutschen Berufskrankheitenrecht die Voraussetzungen für die Anerkennung eines Aderhautmelanoms durch Schweißen gegeben sind.
Methode: Eine systematische Literaturrecherche zum Zusammenhang zwischen dem Aderhautmelanom-Erkrankungsrisiko und Schweißen wurde durchgeführt.
Ergebnisse: Ein Zusammenhang von Schweißarbeit beziehungsweise Photokeratitis (unter anderem durch Schweißen) und Aderhautmelanomen wurde mehrfach in Fall-Kontroll-Studien und einer Metaanalyse untersucht. Obwohl sich mehrheitlich positive Assoziationen zeigten, ist die Kausalität durch die häufig fehlende statistische Signifikanz der Ergebnisse, der Überlappung einiger Studienkollektive und unklare Pathomechanismen stark limitiert. Ein erheblich höheres (= verdoppeltes) berufliches Aderhautmelanomrisiko für Schweißer lässt sich aktuell nicht sicher ableiten.
Schlussfolgerung: Die gegenwärtige Datenlage ist hinsichtlich Art und Stärke eines Kausalzusammenhangs zwischen Schweißen und dem Aderhautmelanom-Erkrankungsrisiko heterogen und entspricht aus wissenschaftlicher Sicht nicht den Anforderungen des deutschen Berufskrankheitenrechts. Es bedarf weiterer kritischer Beobachtung und Forschung hinsichtlich des pathogenen Agens, Wirkmechanismus, der Dosis-Wirkungs-Beziehung und Quantifizierung des beruflichen Anteils.
Schüsselwörter: Aderhautmelanom – Schweißen – Photokeratitis – Berufskrankheit – Kausalität
Artificial UV radiation as a result of welding and uveal melanoma
Background: The „International Agency for Research on Cancer“ (IARC) has established a causal relationship between welding and the occurrence of uveal melanoma and it classified welding as a human carcinogen in its Mono-graphs 100D (2012). A literature review has now been undertaken as to whether uveal melanoma caused by welding meets the requirements for being recognised as an occupational disease under German legislation.
Method: A systematic literature search was conducted on the association between the risk of a uveal melanoma and welding.
Findings: An association between welding or photokeratitis (inter alia through welding) and uveal melanoma was investigated in multiple case-control studies and one meta-analysis. Although predominantly positive associations were found, the causation was greatly limited by the frequent lack of statistical significance in the findings, the overlap of some study collectives and uncertain pathomechanisms. It is not currently possible to infer with sufficient certainty that welders have a considerably higher (= double) risk of job-related uveal melanoma.
Conclusion: Current literature varies in terms of the nature and strength of a causal relationship between welding and the risk of a uveal melanoma and does not meet the scientific requirements of German occupational disease legislation. Further critical monitoring and research is needed regarding the pathogenic agent, a mechanism of action, a dose-effect relationship and the exact extent to which occupation is relevant.
Keywords: uveal melanoma – welding – photokeratitis – occupational disease – causation
ASU Arbeitsmed Sozialmed Umweltmed 2016; 51: 201–210
Einleitung
In der westlichen Welt werden 2–10 % aller Krebstodesfälle beruflich verursacht (Doll u. Peto 1981; Dreyer et al. 1997; IARC 2007; Landrigan u. Markowitz 1989; Leigh et al. 1997; Nurminen u. Karjalainen 2001; Rush-ton et al. 2010; Steenland et al. 2003). Durch Identifikation und Meidung der entsprechenden Kanzerogene ließe sich ein Großteil verhindern und Gesamtinzidenz sowie Kosten für die Sozialversicherungssysteme könnten gesenkt werden.
Melanome der Uvea sind die häufigsten primären Augentumoren und gehören zu den selteneren Malignomerkrankungen mit In-zidenzraten von etwa 4–5/1 000 000 (Osterlind 1987; Virgili et al. 2007) in Mitteleuropa. Die 5-Jahres-Überlebensrate liegt bei 60 bis 80 % (Virgili et al. 2008; Schmidt-Pokrzyw-niak et al. 2014)1. In einer Meta-Analyse wurde ein signifikant erhöhtes Risiko, an einem Aderhautmelanom zu erkranken, für Schweißer gefunden (Shah et al. 2005).
Die IARC stellte aufgrund von Studien zu künstlicher UV-Strahlung einen Kausalzusammenhang zwischen Schweißen und Aderhautmelanomen her und stufte Schweißen als Humankanzerogen ein (IARC 2012).
Berufskrankheiten sind nach deutschem Recht Krankheiten, die durch besondere Einwirkungen verursacht sind, denen bestimmte Personengruppen durch ihre Arbeit in erheblich höherem Grad als die übrige Bevölkerung ausgesetzt sind. Krankheiten können als Berufskrankheit anerkannt und entschädigt werden, wenn sie in der Anlage zur Berufskrankheiten-Verordnung (BKV) gelistet werden. Nicht in der Liste aufgeführte Krankheiten können bei neuen wissenschaftlichen Erkenntnissen über § 9 Abs. 2 BKV wie eine Berufskrankheit anerkannt werden. Dies muss in einem Gutachten über eine kritische Bewertung der wissenschaftlichen Literatur belegt werden. Das „in erheblich höherem Grade“ bezieht sich auf das Erkrankungsrisiko und ist juristisch nicht exakt definiert. In den letzten Jahren wurden allerdings mehrere Berufskrankheiten ab einem relativen Risiko von zwei konkret definiert (beispielweise Gonarthrose: Kniebelastung von mindestens 13 000 Stunden). Bei einem durch die Arbeit verdoppelten Risiko (RR = 2) trägt die Arbeit mit 50 % zum Erkrankungsrisiko bei (Drexler et al. 2012).
Für die Anerkennung eines Aderhautmelanoms als Berufskrank-heit wäre somit das Risiko durch eine spezifische berufliche Einwirkung (künstliche UV-Strahlung) für bestimmte beruflich exponierte Personengruppen (Schweißer) unter Beachtung von Plausibilität, konkurrierenden Faktoren und langen Latenzzeiten zu prüfen.
In dieser Übersichtsarbeit soll untersucht werden, ob Aderhautmelanome durch Schweißen die Kriterien des deutschen Berufskrankheitenrechts erfüllen.
Methoden
Es wurde eine systematische Literaturrecherche bei PubMed und der Cochrane Library zur Frage „Führt eine Exposition gegenüber künstlicher UV-Strahlung beim Schweißen zu einem verdoppelten Risiko, an einem Aderhautmelanom zu erkranken?“ durchgeführt ( Abb. 1). Aufgrund der epidemiologischen Fragestellung stellte sich die Cochrane Library als ungeeignet dar.
Die Literatur wurde von zwei Wissenschaftlern unabhängig voneinander gesichtet und bewertet. Ausschlusskriterien waren Fallkollektive mit Personen unter 15 Jahren, sekundäre Augentumoren, Lokalisationen außerhalb des Augapfels, allgemeine Berufsgruppenbezeichnungen ohne Einzelerfassung von Schweißarbeit, Risikoberechnungen ohne eigenständige Daten und Publikationen, die nicht auf Englisch oder Deutsch verfasst wurden.
Die Datenlage wurde dann anhand der Kausalitätskriterien nach Bradford-Hill (Hill 1965) auf Plausibilität überprüft.
Ergebnisse
Die unterschiedlichen Suchanfragen ( Tabelle 1) ergaben teils doppelte Treffer, so dass 75 verschiedene Publikationen identifiziert werden konnten. Über Zitatverweise wurde die Literatur um 25 Publikationen erweitert. 38 Artikel wurden im Volltext gelesen (Ajani et al. 1992; Dixon u. Dixon 2004; Drever 1995; Egan-Baum et al. 1982; Emmett et al. 1981; Gallagher et al. 1985, 1988; Gallagher u. Lee 2006; Ganley u. Fontenot 1997; Guénel et al. 2001; Holly et al. 1990, 1996; Kolstad et al. 1992; Lutz et al. 1999, 2005; Lynge u. Thygesen 1990; Mainster u. Turner 2010; Milham 1997; Monárrez-Espino et al. 2002; Rushton et al. 2010, 2012; Schmidt-Pokrzywniak et al. 2007, 2009; Seddon et al. 1990; Shah et al. 2005; Siemiatycki 1991; Smith u. Egan 1980; Stang et al. 2003; Swanson u. Burns 1995; Swerdlow 1983; Tenkate 1998; Tucker et al. 1985; Turaka et al. 2011; Vagero et al. 1990; Vajdic et al. 2002, 2004; Zinkhan et al. 2013). Unter Berücksichtigung der Ausschlusskriterien verblieben 12 Treffer mit eigenständigen Risikoberechnungen (Ajani et al. 1992; Guénel et al. 2001; Holly et al. 1990, 1996; Lutz et al. 2005; Monárrez-Espino et al. 2002; Schmidt-Pokrzywniak et al. 2009; Seddon et al. 1990; Siemiatycki 1991; Stang et al. 2003; Tucker et al. 1985; Vajdic et al. 2004) (s. Abb. 1 und Tabelle 2). Zusätzlich fanden sich eine Metaanalyse von Shah et al. 2005 und ein Case-Report (Turaka et al. 2011).
Die IARC Monografie 100D (IARC 2012) enthält neun dieser Referenzen: Acht Publikationen (Ajani et al. 1992; Guénel et al. 2001; Holly et al. 1996; Lutz et al. 2005; Seddon et al. 1990; Siemiatycki 1991; Tucker et al. 1985; Vajdic et al. 2004) aus Daten von sechs verschiedenen Fall-Kontroll-Kollektiven und die Metaanalyse (Shah et al. 2005) zu UV-Strahlung und Aderhautmelanomen.
Die Metaanalyse (Shah et al. 2005) basiert auf sechs der Publikationen (Ajani et al. 1992; Guénel et al. 2001; Holly et al. 1996; Seddon et al. 1990), – Serie 1, (Tucker et al. 1985, Vajdic et al. 2004), von denen fünf zur Berechnung des OR von 2,05 (95 % KI: 1,20–3,51) fürs Schweißen herangezogen wurden.
Weiterhin fanden sich fünf neue Publikationen (Holly et al. 1990; Monárrez-Espino et al. 2002; Schmidt-Pokrzywniak et al. 2007, 2009; Stang et al. 2003) aus drei verschiedenen Fall-Kontroll-Studien, darunter ein „Editorial Letter“ von Schmidt-Pokrzywniak et al. 2007 mit vorab publizierten Studienergebnissen (Schmidt-Pokrzywniak et al. 2009). Die vier relevanten Einzelpublikationen untersuchten hauptsächlich Assoziationen von Augenverblitzungen und Aderhaut-melanomen (Holly et al. 1990; Monárrez-Espino et al. 2002; Schmidt-Pokrzywniak et al. 2009; Stang et al. 2003). Nur Monárrez-Espino et al. 2002 ermittelte ein OR für Schweißarbeit.
Der Case Report beschreibt beidseitige Aderhautmelanome bei einem 57-jährigen Lichtbogenschweißer nach 15-jähriger Tätigkeit.
Insgesamt fanden sich daher neun Publikationen mit zehn berechneten Risikoschätzern (OR/RR 0,9–10,9) zur Assoziation zwischen Schweißarbeit und Aderhautmelanomen. Zusätzlich wurden fünf Studien zu Augenverblitzungen (u. a. durch Schweißen) und Aderhautmelanomen mit RR/OR von 0,6–7,2 identifiziert. Hinsichtlich der einzelnen Studienergebnisse siehe Tabelle 2 und 3.
Diskussion
Seit längerem diskutieren Experten über einen Zusammenhang zwischen Schweißarbeit und der Erkrankung an Aderhautmelano-men. Nachdem die IARC Schweißen als Humankanzerogen einstufte, wurde auch in Deutschland überlegt, ob Aderhautmelanome durch künstliches UV-Licht hervorgerufen werden und ob für Aderhautmelanome durch Schweißarbeit ab einer quantifizierbaren Dosis eine Risikoverdopplung im Sinne des deutschen Berufskrankheitenrechts nachzuweisen ist.
Um in der Epidemiologie aus beobachteten Assoziationen Rück-schlüsse auf die Kausalität zu ziehen, werden häufig die „Bradford-Hill-Kriterien“ (Ergebniskonsistenz, Stärke und Spezifität der Asso-ziation, biologische Plausibilität, richtige zeitliche Beziehung, Dosis-Wirkungs-Beziehung, statistische Signifikanz sowie Bias und Confounding) (Hill 1965) herangezogen. Diese sind weder beweisend noch widerlegend (Phillips u. Goodman 2004), können aber als hilfreiches Instrumentarium im Bewertungsprozess dienen und sollen im Folgenden diskutiert werden.
Hinsichtlich der Ergebniskonsistenz ist festzuhalten, dass mit sie-ben (Guénel et al. 2001; Holly et al. 1996; Lutz et al. 2005; Monárrez-Espino et al. 2002; Siemiatycki 1991; Tucker et al. 1985; Vajdic et al. 2004) der neun Publikationen zur Assoziation zwischen Schweißarbeit und Aderhautmelanomen ein Großteil der Datenlage einen positiven, wenn auch nicht immer signifikanten Zusammenhang (RR/OR 1,2–10,9) sieht (s. Tabellen 2 und 3, Abb. 2). Ajani et al. 1992 findet keine Assoziation (OR 0,99) und Seddon et al. 1990 ist aufgrund der unterschiedlicher Ergebnisse in seinen zwei Teilkollektiven (RR 1,3 und 0,9) ambivalent. Die neun Studien und zehn Risikoschätzer beruhen jedoch teils auf den gleichen oder überlappenden Fall-Kontroll-Kollektiven (s. Tabelle 2) und dieselben Rohdaten führen mitunter zu unterschiedlichen Risikoberechnungen. Die Datengrundlage bilden sieben separate Fall-Kontroll-Kollektive (Holly et al. 1996; Lutz et al. 2005; Monárrez-Espino et al. 2002; Seddon et al. 1990; Siemiatycki 1991; Tucker et al. 1985; Vajdic et al. 2004; Ajani et al. 1992 und Guénel et al. 2001 sind vollständig in anderen Kollektiven – Lutz et al. 2005; Seddon et al. 1990 – enthalten). Zwei Kollektive (Lutz et al. 2005; Monárrez-Espino et al. 2002) überschneiden sich teilweise (Monárrez-Espino et al. 2002 ent-hält Teile (n = 37) des deutschen Teilkollektivs (n = 39) von Lutz et al. 2005 und weitere Fälle (n = 81)). Das Kollektiv von Seddon et al. 1990 besteht wiederum aus zwei Teilkollektiven, die sich zum Teil (n = 140) überschneiden und für die getrennte Berechnungen durchgeführt wurden.
Shah et al. 2005 nutzte in der Metaanalyse für seine Risikobe-rechnung fürs Schweißen fünf dieser Studien und beschränkte sich auf positive Ergebnisse (Seddon et al. 1990 – Serie 1 statt der Alter-nativen Serie 2 oder Ajani et al. 1992). Zwei proportionale Mortalitäts-studien, die Todesursache und Berufsgruppe korrelierten (Drever 1995; Milham 1997), fanden kein erhöhtes Risiko für Augenkrebs bei Schweißern, ebenso wenig der Literaturreview (Kolstad et al. 1992) über berufliche Ursachen seltener Krebserkrankungen. Weder diesem Literaturreview noch der zugrunde liegenden Originalpublikation von Lynge et al. (1990) lassen sich quantitative Risiko-Angaben ent-nehmen.
Die Stärke der Assoziation schwankt etwa um den Faktor 10. Sieben Risikoberechnungen liegen im Bereich von 0,9–2,2, während drei Studien deutliche höhere Werte von 7,3–10,9 angeben (s. Tabelle 3). Einfluss hierauf dürften uneinheitliche Expositionsdefini-tionen, Kontrollgruppenselektion und Kollektivgröße haben, die eine Vergleichbarkeit der Studien einschränken. Bei Lutz et al. (2005) wurde beispielsweise für Schweißer im Gesamtkollektiv (n = 292 Fälle) ein signifikant erhöhtes RR von 1,95 (1,08–3,52) berechnet. Bei Auswertung nach Kontakt zu Schweißen ohne spezielle Berufs-bezeichnung zeigte sich kein erhöhtes Risiko (RR 0,94; KI 0,62–1,46). Außerdem wurden Einzelberechnungen für Männer (n = 164; RR von 2,18 [1,18–4,04]) und Frauen (RR von 0,75 [0,09–6,33]) durchgeführt. Nach Datenexklusion des französischen Teilkollektivs (n = 50) von Guénel et al. (2001), der ein deutlich erhöhtes RR von 7,3 (2,6–20,1) für männliche Schweißer (n = 29 Fälle) berechnete, war das Risiko bei den Männern nicht mehr signifikant erhöht (RR 1,22; KI 0,54–2,73) (Lutz et al. 2005).
Für die grafische Darstellung der einzelnen Studienergebnisse (s. Abb. 2) wurden daher für Lutz et al. (2005) die Berechnungen für Frauen und Männer getrennt und bei den Männern unter Exklusion von Guénel et al. (2001) aufgetragen. Dies verringert die Ergebnisse aus sich überlappenden Kollektiven. Für die anderen sich überschnei-denden Studienkollektive ist eine getrennte Darstellung nicht möglich. Die dargestellten Ergebnisse beziehen sich daher, wie schon erwähnt, mitunter auf die gleichen Kollektive (Ajani et al. 1992 und Seddon et al. 1990 – Serie 1 –, Seddon et al. 1990 – Serie 1 und 2 – mit n = 140 Überschneidungen, Monárrez-Espino et al. 2002 und Lutz et al. 2005 mit n = 37 Überschneidungen). Aufgrund dessen so-wie der, wie nachfolgend noch ausgeführt wird, uneinheitlichen Expositionsdefinition ist nach Ansicht der Autoren eine quantitative Metaanalyse und Berechnung eines gepoolten Effektschätzers nicht sinnvoll.
Aufgrund der seltenen Erkrankung wurden außerdem teils sehr kleine Fallkollektive (n 2 (wie im deutschen BK-Recht gefordert) findet sich bei vier Einzelstudien mit insgesamt n = 717 Fällen. Die Metaanalyse ermittelte ein OR von 2,05 (95 % KI: 1,20–3,51) und berücksichtigte dafür n = 1137 Fälle (Shah et al. 2005).
Wie die Stärke wird auch die Spezifität der Assoziation durch die unterschiedliche Erfassung von Schweißarbeiten beeinflusst. Während ein Teil der Studien konkret die Be-rufsbezeichnung „Schweißer“ erfragt (Gué-nel et al. 2001; Lutz et al. 2005), wird in anderen Fällen nur nach „Kontakt zu Schweißen“ (Tucker et al. 1985; Vajdic et al. 2004) oder spezifisch nach „Lichtbogenschweißen“ (Seddon et al. 1990) gefragt. Die Exposition hinsichtlich Art, Dauer, Umfang und konkurrierender Faktoren ist daher schwer ver-gleichbar. Da bisher weder biologische Plau-sibilität noch Dosis-Wirkungs-Beziehung ge-klärt sind und ein spezifisches ursächliches Agens der Schweißarbeiten für Aderhautmelanome (UV-, Infrarot-, Radiofrequenzstrahlung, Schweißdämpfe, Asbest, chemische Arbeitsstoffe, Niedrigfrequenzfelder) nicht identifiziert werden konnte, ist die As-soziation eingeschränkt.
In diesem Zusammenhang sind auch fünf Studien (Guénel et al. 2001; Holly et al. 1990; Schmidt-Pokrzywniak et al. 2009; Stang et al. 2003; Vajdic et al. 2004) zu Augen-verblitzungen (u. a. durch Schweißen) und Aderhautmelanomen erwähnenswert. Die Ergebnisse mit RR/OR von 0,6–7,2 zeig-ten keine einheitlichen Assoziationen oder Dosis-Wirkungs-Beziehungen bei meist feh-lender statistischer Signifikanz (s. Tabellen 2 und 3). Eine Metaanalyse der Publikationsdaten bis 2005 war von Shah et al. (2005) aufgrund der kleinen Studienzahl (n = 3) nicht erstellt worden.
Eine selektive Betrachtung des Schweißens ist bei Augenverblitzungen nicht möglich, da diese auch durch Sonne oder Schnee verursacht werden können, so dass für die BK-rechtliche Beurteilung ausschließlich die Studien zur Schweißarbeit berücksichtigt wurden.
Die biologische Plausibilität des Zusammenhangs zwischen künst-licher UV-Strahlung und Aderhautmelanomen ist eingeschränkt, auch wenn es denkbar wäre, dass UV-Strahlung an der Entstehung von Aderhautmelanomen beteiligt ist (Shah et al. 2005). Beim Er-wachsenen wird jedoch die Dosis der UV-Strahlung, die die Aderhaut erreicht, durch die Absorption der Linse und Kornea zuneh-mend limitiert, so dass dort keine UVB- und nur wenig UVA-Strah-lung ankommen (Barker u. Brainard 1991; Boettner u. Wolter 1962; Mainster et al. 2010). Pathophysiologisch müssten die meisten Mela-nome daher in UV-exponierten Regionen (Makula, untere Iris) auftreten, die Studienlage hierzu ist jedoch inkonsistent (Horn et al. 1994; Li et al. 2000; Schwartz et al. 1997). Als möglicher Mechanis-mus wird eine Aderhautschädigung durch eine Kettenreaktion über freie Radikale der Retina diskutiert (Holly et al. 1996), ebenso die In-frarotstrahlung als Anteil des Lichtspektrums (Guénel et al. 2001), die jedoch zumeist nicht die Hauptkomponente der Schweißstrahlung ist (Tenkate 1998). Diese enthält als künstliche UV-Quelle poten-zielle Risiken durch ein größeres ultraviolettes Spektrum in variierenden Anteilen und mögliche Spitzenexpositionen (Guénel et al. 2001; Okuno 1985; Tenkate 1998). Augenverblitzungen als Schädigungsfolge durch hohe UV-Expositionen zeigten keine einheitlichen Assoziationen mit Aderhautmelanomen und widersprechen daher einem Risikozusammenhang.
Die biologische Plausibilität eines Kausalzusammenhangs mit UV-Strahlung wird durch Guénel et al. (2005) weiter eingeschränkt. Dort wurde Autogen-Schweißen (mit vorherrschender Infrarot-Strahlung und niedriger UV-Emission) von Erkrankten durchschnittlich länger als von Kontrollen ausgeübt (22 vs. 13 Jahre), während Lichtbogenschweißen (mit höherer UV-Emission) je etwa gleich lang verrichtet wurde (9 vs. 10 Jahre).
In der Literatur werden mögliche adverse und onkogene Effekte durch UV-Strahlung und Blaulicht auf biologischer und experimenteller Ebene diskutiert. Es fehlen jedoch konsistente Erkenntnisse (Di Cesare et al. 2009; Fernandes et al. 2006; Mainster et al. 2010; Marshall et al. 2006; Mooy et al. 1991; Okuno et al. 2002; Tenkate 1998; Zigman 1983).
Das Auftreten einer Krebserkrankung in der richtigen zeitlichen Beziehung, also nach dem Kontakt zur vermuteten Ursache (= Schwei-ßen), erfüllt nur die einfachsten biologischen Voraussetzungen für einen Zusammenhang. Eine Beurteilung von Latenzzeiten und deren zeitlicher und biologischer Plausibilität als deutlich wertvollere Kausalargumente waren jedoch anhand der Datenlage nicht möglich.
Eine klare Dosis-Wirkungs-Beziehung ist anhand der Datenlage nicht nachvollziehbar ( Tabelle 4). Drei Studien versuchten eine Quantifizierung der Schweißarbeit (Guénel et al. 2001; Holly et al. 1996; Vajdic et al. 2004). Während die Lebenszeitstunden (mit dem direktesten Bezug zur Expositionshöhe) bei nicht signifikanten Er-gebnissen keinen Dosisbezug erkennen ließen, ist dieser bei der Beschäftigungsdauer zu diskutieren. Eine Dosisabhängigkeit zeigte sich bei Vajdic et al. (2004), während Holly et al. (1996) die höchsten Risiken bei der kürzesten Dauer ermittelte, jeweils bei fehlender Signifikanz. Die signifikante Dosis-Wirkungs-Korrelation bei Gué-nel et al. (2001) sollte hinsichtlich der geringen Fallzahl (n = 29) vor-sichtig bewertet werden. Die Tätigkeitsdauer mit Schweißarbeit kann zudem nicht proportional zu Lebenszeitstunden gesehen werden, da die tägliche/wöchentliche Exposition an verschiedenen Schweißarbeitsplätzen unterschiedlich ausfallen kann. Noch unspezifischer ist die Dauer vom Tätigkeitsbeginn bis zur Diagnose, wobei weder die Beschäftigungsdauer noch die Höhe an sich quantifiziert werden. Die einzig signifikante Erhöhung zeigte sich hier bei dem längsten Abstand zum Tätigkeitsbeginn. Bei unbekannter Latenzzeit, Patientenalter und Expositionshöhe kann hieraus kein valider Schluss auf eine Dosisabhängigkeit gezogen werden.
Die Bedeutung von Studienergebnissen wird wesentlich von der statistischen Signifikanz mitbestimmt und ist bei den hier diskutierten Risikoberechnungen eingeschränkt. Vier Studien, die ein erhöhtes Risiko für Aderhautmelanome zeigen, schließen im Konfidenzintervall „1“ ein (s. Tabelle 3) und sind daher nicht statistisch signifikant. Bei den Studien mit einem signifikant erhöhten Risiko zeigen sich teilweise breite Streuungen im Konfidenzintervall (u. a. 2,1–56,5).
Zur Qualitätsbewertung der einzelnen Studien sind insbesondere Bias und Confounding zu berücksichtigten. Da das Aderhautmelanom zu den seltenen Erkrankungen gehört, sind Kohorten- oder Querschnittsstudien sehr schwierig und daher nicht sinnvoll oder praktikabel durchführbar. Das somit in allen Studien verwendete Fall-Kontroll-Design ist grundsätzlich anfällig für Bias und Confounding (Klug et al. 2007; Weiß 2013), so dass die Studienqualität mit Einschränkungen betrachtet werden muss.
Aufgrund der seltenen Erkrankung wurden teils sehr kleine Fall-kollektive (n
Ein Selektionsbias kann bei der Auswahl der Kontrollen zum Tragen kommen (Allgemeinbevölkerung, Geschwister oder Patienten).
Zusätzlich muss auch ein möglicher Recall- und Interview-Bias beachtet werden. Eine Verblindung der Interviewer bezüglich der Studienhypothese erfolgte bei sechs der neun Publikationen (Ajani et al. 1992; Guénel et al. 2001; Holly et al. 1996; Monárrez-Espino et al. 2002; Seddon et al. 1990; Vajdic et al. 2004), drei machten hierzu keine Angaben (Lutz et al. 2005; Siemiatycki 1991; Tucker et al. 1985). Der Fall-Kontroll-Status wurde von drei Studien (Ajani et al. 1992; Monárrez-Espino et al. 2002; Seddon et al. 1990) verblindet, eine Studie (Siemiatycki 1991) ließ die Auswertung der Arbeits-anamnese und Expositions-Attribution von verblindeten Experten vornehmen, drei Studien (Holly et al. 1996; Lutz et al. 2005; Tucker et al. 1985) enthielten keine Angaben und zwei Studien (Guénel et al. 2001; Vajdic et al. 2004) verblindeten nicht. Daher können hinsichtlich eines Interview-Bias nur drei Studien (Ajani et al. 1992; Monárrez-Espino et al. 2002; Seddon et al. 1990) als qualitativ höherwertig angesehen werden. Ein Recall-Bias ist bei Fall-Kontroll-Studien und einer retrospektiven Expositionserfassung grundsätzlich nicht auszuschließen. Mögliche Effekte können durch den Ausschluss länger zurückliegender Erstdiagnosen zwar vermindert, aber nicht gänzlich verhindert werden. Des Weiteren muss auch beachtet werden, dass die Expositionsangaben stets auf Patienten-angaben beruhten und die Klassifikation der Expositionskategorien zwischen den verschiedenen Studien differierten.
Weiterhin kann im Hinblick auf die limitierte Datenlage ein Publikationsbias in Richtung positiver Assoziationen vermutet werden. Shah et al. (2005) konnte in seiner Metaanalyse keinen Publikations-bias (P = 0,709) feststellen und verweist auf eine signifikante Hetero-genität der Studien (Q4 = 12,44, P = 0,014), wobei die Aussagekraft dieser Ergebnisse aufgrund der kleinen Studienanzahl eingeschränkt sei.
Die Studienheterogenität umfasst neben Expositionskategorien auch den Ein- oder Ausschluss von Irismelanomen sowie Rekrutierungsmethoden der Kontrollgruppe.
Mögliche Confounder durch andere Expositionseinflüsse an einem Schweißarbeitsplatz wurden in Bezug zur Assoziationsspezifität und biologischen Plausibilität schon diskutiert (Ajani et al. 1992; Guénel et al. 2001; Holly et al. 199; Shah et al. 2005; Siemiatycki 1991; Vajdic et al. 2004). und auch von den einzelnen Studien entsprechend er-wähnt, jedoch nicht notwendigerweise in deren Analyse berücksich-tigt (Siemiatycki 1991). Während bei dem Einschluss einer großen Zahl an Kovariablen die Power eingeschränkt werden kann, können ohne Adjustierung konfoundierende Variablen eine Assoziation vorspiegeln.
Unserer Meinung nach wird die uneinheitliche und limitierte Studienlage sowohl in der Metaanalyse von Shah et al. (2005) als auch in der Monographie 100D von der IARC (2012)nicht ausreichend gewürdigt und in ihrer Qualität beurteilt. Die Hauptkritikpunkte betreffen die Überlappung der Studienkollektive mit Ergebnisbevorzugung von positiven Assoziationen, die oftmals fehlende statistische Signifikanz und unklare Pathomechanismen.
Zusätzlich ziehen die Metaanalyse nur fünf und die IARC acht der neun Publikationen in ihre Beurteilung mit ein. Deshalb sollte insbesondere die Metaanalyse mit ihrem OR von 2,05 (1,20–3,51) nicht zur Bestätigung der im BK-Recht geforderten Risikoverdopplung herangezogen werden.
Die IARC-Monographie legt Assoziationen zwischen Schweißen und dem Auftreten von Aderhautmelanomen dar, schränkt die eindeutige Zuordnung dieser zur UV-Strahlung jedoch selbst ein. Die beschriebenen Assoziationen beobachteten wir auch, der IARC-Schlussfolgerung eines Kausalzusammenhangs insbesondere unter Berücksichtigung der Frage der Entschädigung können wir uns jedoch, wie oben ausgeführt, derzeit nicht anschließen.
Fazit
Es liegen keine Daten vor, aus denen eine Risikoverdopplung für die Erkrankung an einem Aderhautmelanom durch Schweißarbeiten sicher abgeleitet werden kann. Die Quantifizierung (Expositionsjahre, Lebenszeitstunden, Art der Schweißarbeit) eines „erheblichen“ beruflichen Anteils ist ebenfalls nicht möglich, so dass keine der sozialrechtlichen Forderungen im BK-Recht aktuell ausreichend sicher bejaht werden kann. Es bedarf weiterer kritischer Forschung zu der Thematik, um das pathogene Agens, den Wirkmechanismus sowie die unklare Dosis-Wirkungs-Beziehung eruieren zu können. Eine Anerkennung von „Aderhautmelanomen durch künstliches UV-Licht“ als Berufskrankheit nach § 9 (2) BKV oder eine Aufnahme in die Anlage zur BKV kann derzeit medizinisch nicht begründet werden.
Literatur
Ajani UA et al.: Occupation and risk of uveal melanoma. An exploratory study. Cancer 1992; 70: 2891–2900.
Barker FM, Brainard GC: The direct spectral transmittance of the excised human lens as a function of age. FDA 785345 0090 RA. Washington DC: US Food and Drug Administration: 1991.
Boettner EA, Wolter JR: Transmission of the ocular media. Invest Ophthalmol Vis Sci 1962; 1: 776–783.
Di Cesare S et al.: The effect of blue light exposure in an ocular melanoma animal model. J Exp Clin Cancer Res 2009; 28: 48.
Dixon AJ, Dixon BF: Ultraviolet radiation from welding and possible risk of skin and ocular malignancy. Med J Aust 2004; 181: 155–157.
Doll R, Peto R: The causes of cancer: quantitative estimates of avoidable risks of cancer in the United States today. J Natl Cancer Inst 1981; 66: 1191–1308.
Drever F: Occupational Health Decennial Supplement. London: HMSO; 1995.
Drexler H et al.: Arbeitsbedingte UV-Exposition und Malignome der Haut. Arbeitsmed Sozialmed Umweltmed 2012; 47: 550–554.
Dreyer L, Andersen A, Pukkala E: Avoidable cancers in the Nordic countries. Occupation. APMIS Suppl 1997; 76: 68–79.
Egan-Baum E, Smith AB, Albert DM: Ocular melanoma. Am J Ophthalmol 1982; 94: 687–688.
Emmett EA et al.: Skin and eye diseases among arc welders those exposed to welding operations. J Occup Med 1981; 23: 85–90.
Fernandes BF, Marshall JC, Burnier MN Jr: Blue light exposure and uveal melanoma. Ophthalmology 2006; 113: 1062 e1061; author reply 1062.
Gallagher RP et al.: Risk factors for ocular melanoma: Western Canada Melano-ma Study. J Natl Cancer Inst 1985; 74: 775–778.
Gallagher RP et al.: Symptoms and time to presentation and treatment in ocular melanoma: the Western Canada Melanoma Study. Can J Ophthalmol 1988; 23: 11–13.
Gallagher RP, Lee TK: Adverse effects of ultraviolet radiation: a brief review. Prog Biophys Mol Biol 2006; 92: 119–131.
Ganley JP, Fontenot K: Epidemiologic study of time and space clustering of 4 cases of choroidal malignant melanoma. Arch Ophthalmol 1997; 115: 537–541.
Guénel P et al.: Occupational risk factors, ultraviolet radiation, and ocular melanoma: a case-control study in France. Cancer Causes Control 2001; 12: 451–459.
Hill AB: The Environment and Disease: Association or Causation? Proc R Soc Med 1965; 58: 295–300.
Holly EA et al.: Intraocular melanoma linked to occupations and chemical ex-posures. Epidemiology 1996; 7: 55–61.
Holly EA et al.: Uveal melanoma in relation to ultraviolet light exposure and host factors. Cancer Res 1990; 50: 5773–5777.
Horn EP et al.: Sunlight and risk of uveal melanoma. J Natl Cancer Inst 1994; 86: 1476–1478.
IARC: Attributable causes of cancer in France in the year 2000.: Working Group Reports. Lyon: World Health Organization: International Agency for Research on Cancer 2007.
IARC: A review of human carcinogens. Part D: Radiation. Lyon: IARC Working Group on the evaluation of carcinogenic risks to Humans 2012.
Klug SJ et al.: [Common study designs in epidemiology]. Dtsch Med Wochenschr 2007; 132 Suppl 1: e45–47.
Kolstad H et al.: Occupational causes of some rare cancers. A literature review. Scand J Soc Med Suppl 1992; 48: 1–148.
Landrigan PJ, Markowitz S: Current magnitude of occupational disease in the United States. Estimates from New York State. Ann N Y Acad Sci 1989; 572: 27–45; discussion 55–60.
Leigh JP et al.: Occupational injury and illness in the United States. Estimates of costs, morbidity, and mortality. Arch Intern Med 1997; 157: 1557–1568.
Li W et al.: Patterns of tumor initiation in choroidal melanoma. Cancer Res 2000; 60: 3757–3760.
Lutz JM et al.: Occupational risks for uveal melanoma results from a case-control study in nine European countries. Cancer Causes Control 2005; 16: 437–447.
Lutz JM, Cree IA, Foss AJ: Risk factors for intraocular melanoma and occupatio-nal exposure. Br J Ophthalmol 1999; 83: 1190–1193.
Lynge E, Thygesen L: Occupational cancer in Denmark. Cancer incidence in the 1970 census population. Scand J Work Environ Health 1990; 16 Suppl 2: 3–35.
Mainster MA, Turner PL: Ultraviolet-B phototoxicity and hypothetical photo-melanomagenesis: intraocular and crystalline lens photoprotection. Am J Ophthal-mol 2010; 149: 543–549.
Marshall JC et al.: The effect of blue light exposure and use of intraocular lenses on human uveal melanoma cell lines. Melanoma Res 2006; 16: 537–541.
Milham S: Occupational mortality in Washington State 1950–1989. Cincinnati: US Dept Health Human Services 1997.
Monárrez-Espino J et al.: Occupation as a risk factor for uveal melanoma in Ger-many. Scand J Work Environ Health 2002; 28: 270–277.
Mooy CM et al.: No N-ras mutations in human uveal melanoma: the role of ultra-violet light revisited. Br J Cancer 1991; 64: 411–413.
Nurminen M, Karjalainen A: Epidemiologic estimate of the proportion of fatalities related to occupational factors in Finland. Scand J Work Environ Health 2001; 27: 161–213.
Okuno T: Spectra of optical radiation from welding arcs. Ind Health 1985; 23: 53–70.
Okuno T, Saito H, Ojima J: Evaluation of blue-light hazards from various light sources. Dev Ophthalmol 2002; 35: 104–112.
Osterlind A: Trends in incidence of ocular malignant melanoma in Denmark 1943–1982. Int J Cancer 1987; 40: 161–164.
Phillips CV, Goodman KJ: The missed lessons of Sir Austin Bradford Hill. Epidemiol Perspect Innov 2004; 1: 3.
Rushton L et al.: Occupation and cancer in Britain. Br J Cancer 2010; 102: 1428–1437.
Rushton L et al.: Occupational cancer burden in Great Britain. Br J Cancer 2012; 107 Suppl 1: 3–7.
Schmidt-Pokrzywniak A et al.: Risk of uveal melanoma. Ophthalmology 2007; 114: 1418; author reply 1418.
Schmidt-Pokrzywniak A et al.: Positive interaction between light iris color and ultraviolet radiation in relation to the risk of uveal melanoma: a case-control study. Ophthalmology 2009; 116: 340–348.
Schmidt-Pokrzywniak A et al.: Assessment of the effect of iris colour and having children on 5-year risk of death after diagnosis of uveal melanoma: a follow-up study. BMC Ophthalmol 2014; 14: 42.
Schwartz LH et al.: Lack of correlation between the location of choroidal mela-noma and ultraviolet-radiation dose distribution. Radiat Res 1997; 147: 451–456.
Seddon JM et al.: Host factors, UV radiation, and risk of uveal melanoma. A case-control study. Arch Ophthalmol 1990; 108: 1274–1280.
Shah CP et al.: Intermittent and chronic ultraviolet light exposure and uveal melanoma: a meta-analysis. Ophthalmology 2005; 112: 1599–1607.
Siemiatycki J: Risk factors for cancer in workplace. Boca Raton: CRC Press 1991.
Smith AB, Egan EA: The role of epidemiological investigations in the study of ocular tumors. Int Ophthalmol Clin 1980; 20: 63–69.
Stang A et al.: Phenotypical characteristics, lifestyle, social class and uveal mela-noma. Ophthalmic Epidemiol 2003; 10: 293–302.
Steenland K et al.: Dying for work: The magnitude of US mortality from selected causes of death associated with occupation. Am J Ind Med 2003; 43: 461–482.
Swanson GM, Burns PB: Cancer incidence among women in the workplace: a study of the association between occupation and industry and 11 cancer sites. J Occup Environ Med 1995; 37: 282–287.
Swerdlow AJ: Epidemiology of eye cancer in adults in England and Wales, 1962–1977. Am J Epidemiol 1983; 118: 294–300.
Tenkate TD: Optical radiation hazards of welding arcs. Rev Environ Health 1998; 13: 131–146.
Tucker MA et al.: Sunlight exposure as risk factor for intraocular malignant melanoma. N Engl J Med 1985; 313: 789–792.
Turaka K et al.: Bilateral uveal melanoma in an arc welder. Graefes Arch Clin Exp Ophthalmol 2011; 249: 141–144.
Vagero D, Swerdlow AJ, Beral V: Occupation and malignant melanoma: a study based on cancer registration data in England and Wales and in Sweden. Br J Ind Med 1990; 47: 317–324.
Vajdic CM et al.: Sun exposure predicts risk of ocular melanoma in Australia. Int J Cancer 2002; 101: 175–182.
Vajdic CM et al.: Artificial ultraviolet radiation and ocular melanoma in Australia. Int J Cancer 2004; 112: 896–900.
Virgili G et al.: Incidence of uveal melanoma in Europe. Ophthalmology 2007; 114: 2309–2315.
Virgili G et al.: Survival in patients with uveal melanoma in Europe. Arch Ophthalmol 2008; 126: 1413–1418.
Weiß C: Basiswissen Medizinische Statistik. 6 ed. Berlin: Springer Medizin; 2013.
Zigman S: Effects of near ultraviolet radiation on the lens and retina. Doc Ophthalmol 1983; 55: 375–391.
Zinkhan M et al.: Having children, social characteristics, smoking and the risk of uveal melanoma: a case-control study. Ophthalmic Epidemiol 2013; 20: 360–368.
Interessenskonflikt: Die Autoren geben keine Interessenskonflikte an.
Für die Verfasser
Dr. med. Julia Hiller
Institut und Poliklinik für Arbeits-, Sozial- und Umweltmedizin
der FAU Erlangen-Nürnberg
Schillerstraße 25/29
91054 Erlangen
Fußnoten
Institut und Poliklinik für Arbeits-, Sozial- und Umweltmedizin der Friedrich-Alexander-Universität Erlangen-Nürnberg (Direktor: Prof. Dr. med. Hans Drexler)
1 Da es sich überwiegend (80–85 %) um Aderhautmelanome handelt (Virgili et al. 2007; Osterlind 1987; Shah et al. 2005), diese Bezeichnung weithin eher bekannt ist und in den Publikationen keine einheitlichen Termini verwendet werden, wird im Folgenden der Begriff „Aderhautmelanom“ für primäre Melanome der Uvea verwendet.